4. Skammtafræði
4.1. Rafeindaskipan
Rafeindir raða sér ekki tilviljunarkennt kringum kjarnann, heldur skipa þau sér á rafeindahvolf (e. shell) þar sem þau eru fyllt eftir orkulegri hagkvæmni. Efni reynir alltaf að stefna að orkulægsta ástandandinu, enda er það stöðugast. Þá er mikilvægt að geta greint hvað er orkulægsta ástandið.
Frumefni hafa allt að 7 rafeindahvolf og eru þau númeruð með n eða höfuðskammtatölunni (e. principal quantum number) sem tekur gildi \(n=1,2,3,...\)
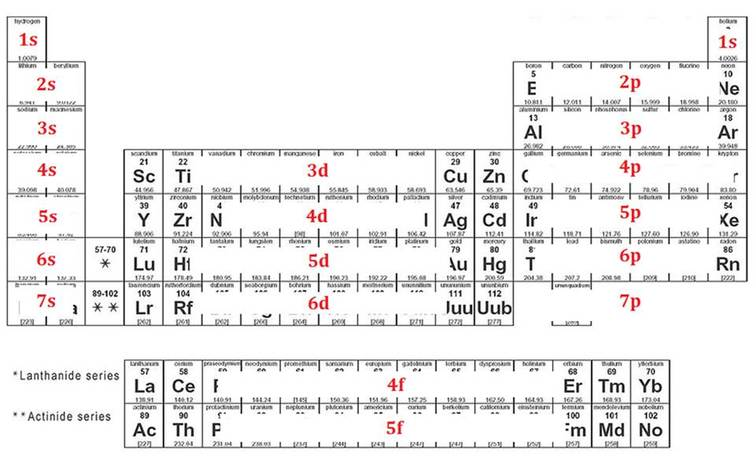
Rafeindahvolfið skiptist svo í undirhvolf (e. subshells). Þessi fjögur undirhvolf eru númeruð með \(\ell\) eða hverfiþungaskammtatölunni (e. Azimuthal quantum number) sem tekur gidli \(\ell=\{0,1,2,3\}\). Undirhvolfin eru oftar táknuð með \(\ell=\{s,p,d,f\}\). Undirhvolfin eru einnig fyllt eftir orkulegri hagkvæmni, þ.e. orkulægstu svigrúmin eru fyllt fyrst. Röðin á þeim má sjá hér á myndinni fyrir neðan en þau eru fyllt á sama hátt og örvarnar stefna ofan frá og niður. \(\require{mhchem}\)

Orkuþrepið \(1s\) svarar til skammtatalnanna \(n=1\) og \(\ell=0\) og er orkulægsta ástandið. Þrepið \(3d\) svarar til \(n=3\), \(\ell=2\) og er sjöunda lægsta ástandið. Hafa ber í huga, eins og sjá má á mynd, að orkuþrep \(3d\) er orkuhærra en \(4s\).
4.1.1. Hvernig skal finna rafeindaskipan frumefnis?
Fjöldi rafeinda er jafn sætistölu frumefnis. Til að finna hvernig rafeindirnar raða sér í kringum kjarnann má nota eftirfarandi mynd, en þá er hægt að byrja efst vinstra megin og rafsvigrúmin fyllt í þeirri röð sem þau koma fyrir. Unnið er til hægri og niður þangað til komið er að frumefninu sem verið er að skoða.
Fjöldi rafeinda á hverju svigrúmi er jafn fjölda frumefna í hverju undirsvigrúmi, þ.e. það komast 2 rafeindir í \(s\) svigrúm, 6 rafeindir í \(p\) sigrúm, 10 rafeindir í \(d\) svigrúm og að lokum 14 rafeindir í \(f\) svigrúm.
Dæmi
Hver er rafeindaskipan brennisteins (\(\ce{S}\)) ? En blýs (\(\ce{Pb}\)) ?
Brennisteinn hefur sætistöluna 16 og því 16 rafeindir. Byrjum á vetni í \(1s\) og vinnum okkur að svigrúmi \(3p\), þar sem brennisteinn er. Þá er rafeindaskipanin:
Eins og sjá má eru einungis 4 rafeindir í \(3p\) svigrúminu (þó þær mættu vera 6) þar sem samanlagður fjöldi þarf að vera 16 (\(2+2+6+2+4 = 16\)).
Hægt er að beita sömu aðferðarfræði á blý, en núna koma \(d\) og \(f\) svigrúm til leiks. Blý hefur sætistöluna 82 og því 82 rafeindir. Blý liggur í svigrúmi \(6p\) í lotukerfinu og er það því lokastöðin. Með því að vinna sig til hægri og niður fæst:
Þá sést að heildarfjöldi rafeinda er \(2+2+6+2+6+2+10+6+2+10+6+2+10+14+2 =82\)
Aðvörun
Þessi röð rafeindanna er rétt fyrir flest frumefni en reglan er þó ekki algild. Fyrir suma hliðarmálma er þessi röð undirsvigrúmanna ekki endilega orkulega hagkvæmust og þegar ákvarða á rafeindaskipan þeirra þarf að taka tillit til sértilvika fyrir hverja rafeindahýsingu.
4.2. Gildisrafeindir
Gildisrafeindir (e. valence electrons) eru þær rafeindir sem eru á ysta hveli frumefnis sem geta tekið þátt í að mynda efnatengi. Fjölda gildisrafeinda er auðvelt að finna út frá lotukerfinu fyrir utan gildisrafeindir hliðarmálmanna, lanþaníðanna og aktiníðanna. Alkalímálmar (eins og \(\ce{Li}\) og \(\ce{Na}\)) hafa eina gildisrafeind á meðan halógenar (eins og \(\ce{F}\) og \(\ce{Cl}\)) hafa 7. Fyrir flest efni eru rafeindir í d og f svigrúmunum ekki gildisrafeindir.
Gildisrafeindir eru einkum þýðingarmiklar í hvarfgirni efna vegna þess að frumefni leitast eftir að hafa 8 gildisrafeindir á ysta hvoli. Þetta heitir áttureglan (e. octate rule). Atóm geta komið fjölda gildisrafeinda í átta með nokkrum leiðum: þau geta t.d. myndað sameind þar sem þau deila gildisrafeindum með öðrum atómum í efnatengjum, eða jónast (e. ionize) þar sem þau kasta af sér umframrafeindum.
Athugasemd
Eðalgastegundir eru einstaklega stöðugar, vegna þess að þær uppfylla átturegluna. Þær eru því mjög óhvarfgjarnar eða óvirkar (e. inert)
Þegar rita á rafeindaskipan stórra frumefna er vaninn að telja ekki upp öll hvolfin og rafeindirnar sem þar eru, heldur einungis rafeindir á ysta hvolinu og tákn eðalgastegundarinnar fyrir framan í hornklofa. Þetta er gert til að einfalda ritháttin auk þess sem gildisrafeindir koma mun oftar við sögu en þær sem eru innar.
Dæmi
Hver er rafeindaskipan blýs, skrifað með þessum styttri rithátt?
Nú er Xenon eðalgastegundin í lotunni fyrir ofan blý. Því er byrjað þar og þá fæst:
\[[Xe] 6s^2 5d^{10} 4f^{14} 6p^{2}\]
Ef rafeindir á d og f svigrúmum eru ekki talin með sést að blý hefur \(2+2=4\) gildisrafeindir.
4.3. Rafeindaskipan áframhald
Rafeindir hafa fleiri en þessar tvær skammtatölur sem hafa verið nefndar, \(n\) og \(\ell\) . Auk þeirra eru \(m_{\ell}\), segulskammtatalan (e. magnetic quantum number) og \(m_S\) sem er spunaskammtatalan (e. spin quantum number). \(m_\ell\) segir til um í hvaða átt svigrúmið snýr en \(m_S\) segir aftur á móti til um spuna rafeindarinnar.
Ekki verður farið nánar út í það hér en gott að vita að engar tvær rafeindir á atómi hafa sömu fjórar skammtatölur og skammtatölurnar er hægt að tilgreina á myndrænan hátt. Þá fær hvert hvolf og undirhvolf kassa sem rafeindirnar eru svo merktar inn á. Fjöldi kassa fer eftir gerð undirhvolfa og eru helmingur fjölda rafeinda á fullu undirhvolfi. Að lokum eru svo rafeindirnar táknaðar sem örvar sem snúa upp eða niður, sem tilgreinir spuna rafeindarinnar. Fullt hvolf hefur þá rafeind bæði upp og niður í hverjum kassa. Þetta skýrist best með dæmi:
Dæmi
Tilgreindu fulla rafeindaskipan brennisteins (\(\ce{S}\)).
Brennisteinn er númer 16 í lotukerfinu en síðasta eðalgasið á undan því er Neon, sem hefur 10 rafeindir. Brennisteinn hefur þess vegna 6 gildisrafeindir, 2 á \(3s`og 4 á :math:`4p\). Byrjum á að teikna upp kassana fyrir svigrúmin, en þar sem það komast 2 rafeindir á \(s\) hvolf teiknum við einn kassa fyrir það, en á \(p\) hvolf komast 6, þannig við teiknum 3 kassa.
Byrjum á því að fylla tvær rafeindir inn í 3s svigrúmið og látum aðra þeirra benda upp en hina niður:
Með einungis 4 rafeindir er 3p svigrúmið ekki fullt og því þarf að passa hvernig fylla skal í það. Fyrst skal fylla í alla kassana (eða sem flesta kassa) með bara einni ör og eftirstandandi rafeindir fylltar inn eftir það. Þ.e. ekki setja tvær örvar í kassa, meðan það eru enn tómir kassar. Það er gert til að fylgja eftir svokallaðari reglu Hund’s.
Regla Hunds
Regla Hund’s segir til um að það sé orkulega hagkvæmast og þannig stöðugast þegar rafeindir skipa sér stakar á svigrúm, meðan kostur er. Þær hafa þá sama spuna.
Þessi regla er oft kölluð strætisvagnareglan, þar sem vaninn er að setjast ekki í sætisröð með öðrum, ef það er tóm sætisröð í vagninum.