2. Frumefni og sameindir
2.1. Atóm
Í efnafræði er efni skilgreint sem svo að það hefur massa og hefur rúmmál. Atóm er örsmá grunneining sem allt efni í alheiminum er búið til úr. Nú eru þekktar 118 tegundir atóma, þar sem hver tegund telst sem eitt frumefni (e. element). Þó atóm séu örsmá þá eru þau ekki minnsta eining efnis, en þau eru gerð úr jákvætt hlöðnum róteindum (e. proton), neikvætt hlöðnum rafeindum (e. electron) og hleðslulausum nifteindum (e. neutron). Róteindir og nifteindir mynda kjarna (e. nucleus) atómsins meðan rafeindirnar sveima kringum kjarnann.
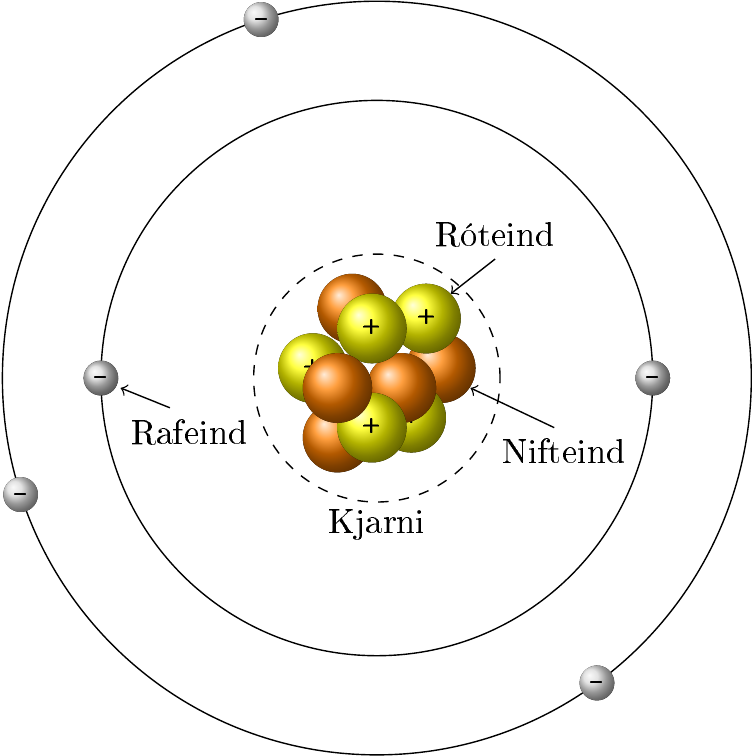
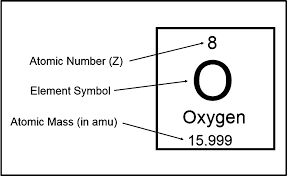
Gerð frumefnis ákvarðast af fjölda róteinda í kjarna þess. Sem dæmi má nefna að vetni hefur alltaf 1 róteind í kjarna á meðan helíum hefur alltaf 2 róteindir í sínum kjarna. Ólík frumefni hafa ólíkan fjölda róteinda í kjarna. Frumefni eru hleðslulaus vegna þess að þau hafa jafnan fjölda af róteindum og rafeindum. Sætistala (e. atomic number) frumefnis er fjöldi róteinda í kjarnanum. Frumefni getur þó haft mismunandi fjölda nifteinda í kjarna og mynda þá mismunandi samsætur (e. isotopes). Samsætur hafa mismunandi massatölu (e. mass number), en massatala er samanlagður fjöldi nifteinda og róteinda. Massi rafeindar er svo lítill (\(m_e=9,11\cdot 10^{-31}\) kg) miðað við hinar tvær öreindirnar (\(m_n \approx m_p=1,67\cdot 10^{-27}\) kg) að ekki þarf að taka tillit til massa þeirra í massatölu samsætu. Samsætur eru svo nefndar eftir massatölu sinni, t.d. kolefni-13 (C-13) hefur massatöluna 13. Massatala hefur eininguna amu (atómmassaeining (e. atomic mass unit))
Dæmi
Kolefni hefur sætistöluna 6. Hver er fjöldi nifteinda, róteinda og rafeinda í C-13?
Kolefni hefur sætistöluna 6, og hefur því 6 róteindir og rafeindir. Nú er jafnan fyrir massatölu:
þar sem A er massatalan, Z er fjöldi róteinda, og N er fjöldi nifteinda. Þá má sjá að fyrir massatölu 13 og 6 róteindir fæst að það eru 7 nifteindir í C-13
2.2. Lotukerfið
Fyrsta lotukerfið (e. The Periodic Table) var smíðað af Mendeleev árið 1869, þar sem frumefnunum var raðað eftir sætistölu (e. atomic number), þ.e. fjölda róteinda. Þeim var svo hópað saman eftir efnafræðilegum eiginleikum. Þó svo að ekki hafi öll frumefnin verið fundin á þessum tíma, tókst Mandeleev að mestu leyti að áætla hvar vantaði frumefni, með því að tengja sætistöluna við eiginleika frumefnisins. Einungis fyrstu 94 frumefnin finnast náttúrulega en frumefni 95-118 hafa verið smíðuð á rannsóknarstofu.
Góð vefsíða fyrir lotukerfið er t.d. þessi, en þar er hægt að velja íslensku og ensku og fá upplýsingar um ýmsa eiginleika allra frumefnanna.
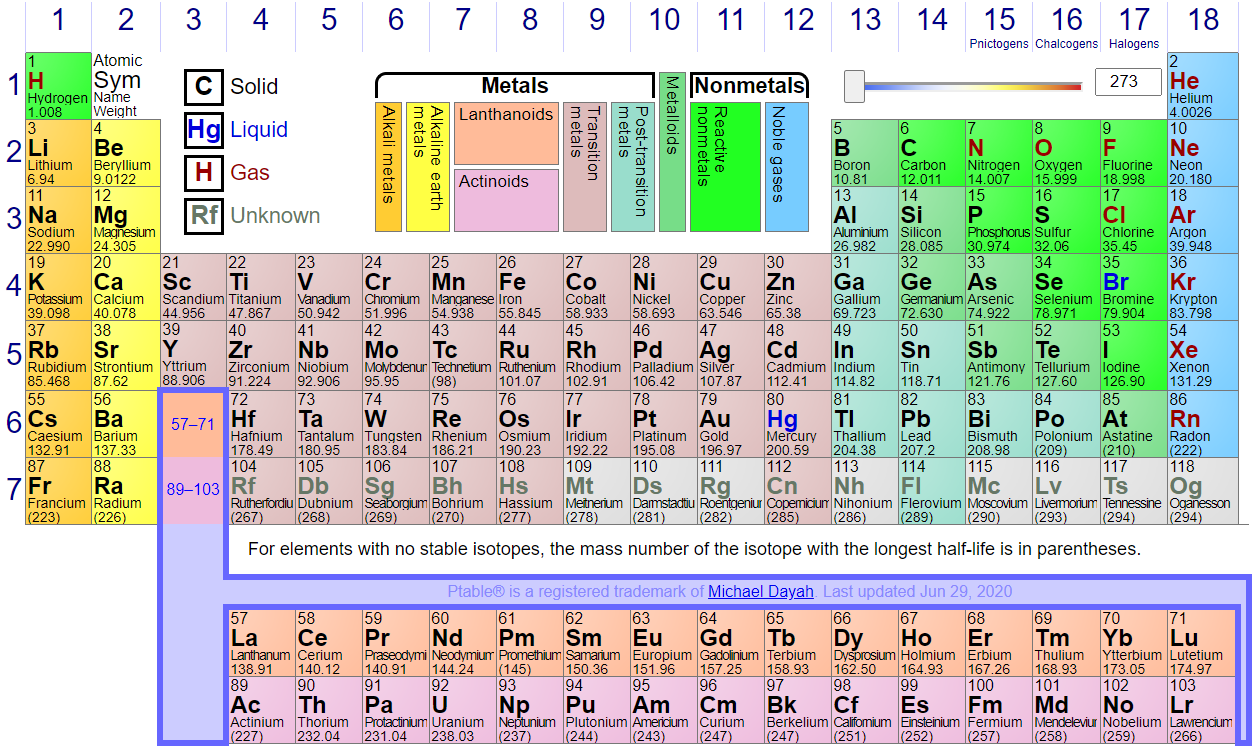
Lotukerfið hefur sjö raðir, þar sem lotubundnir eiginleikar koma fram, og 18 dálka þar sem hver hópur hefur sameiginlega efnafræðilega eiginleika. Þessir hópar hafa margir eigið nafn, t.d. heitir hópur 1 alkalímálmar og hópur 2 jarðalkalímálmar, en hópur 17 ber nafnið halógenar og 18 eðalgastegundir. Efnin í lotukerfinu flokkast líka í málma, hálfmálma og málmleysingja. Á myndinni fyrir neðan, sem er fengin af ptable.com, sést skipting efnanna í lotukerfinu í flokka.
2.3. Sameindir
Sameindir (e. molecule) myndast þegar tveir eða fleiri málmleysingjar koma saman og tengjast efnatengjum. Sameind getur verið af einni gerð frumefnis, t.d. vetnisgas sem hefur efnaformúluna, \(\require{mhchem} \ce{H_2}\) eða nitur í andrúmslofti, \(\ce{N_2}\). Þegar sameind er gerð úr fleiri en einni tegund af frumefni, kallast það efnasamband (e. chemical compound). Dæmi um þetta væri t.d. vatnssameind, \(\ce{H_2O}\) sem hefur tvö vetnisatóm og eitt súrefnisatóm.
2.4. Jónaefni
Jónaefni eru svipaðar og sameindir en það er smíðað úr jónum (e. ions). Jónir hafa ekki sama fjölda rafeinda (-) og róteinda (+) og fá þannig hleðslu. Jónir með mismunandi hleðslur koma saman og mynda jónaefni en jónir geta einnig fundist stakar í lausn (e. solution), þ.e. uppleystar.
Það verður fjallað ítarlegra um jónaefnið og jónatengi í næstu köflum.
2.5. Efnaformúlur
Uppbygging efna er lýst með formúlu, t.d. jónin
Hér lýsa stafirnir hvað frumefni eru í sameindinni (\(\ce{N}\) fyrir nitur og \(\ce{O}\) fyrir súrefni), \(_3\) lýsir fjölda súrefnisatóma, en \(^-\) er heildarhleðsla sameindarinnar. Einungis er settur tölustafur í hnéskrift ef það er fleiri en eitt atóm af efninu.
Að lokum segir \(\ce{(aq)}\) til um að efnið sé uppleyst í vökva. Þá er einnig notað \(\ce{(s)}\), \(\ce{(l)}\) og \(\ce{(g)}\) til að lýsa sameindinni sem föstu efni, vökva eða gasi.
2.6. Mól
Atóm og aðrar eindir eru svo litlar að það er ekki hentugt að reikna fyrir stakar eindir. Þess í stað er notað mól. Mól er fjöldi sem notað er yfir eindir, en þessi fjöldi er skilgreindur sem fjöldi atóma í 12 grömmum af C-12 samsætunni. Þessi fjöldi er nefndur Avogadrostala og hefur gildið
Sumir eiga það til að flækja hugtakið í huganum, en mól lýsir einfaldlega fjölda einda líkt og kippa af gosi lýsir 6 dósum!
2.6.1. Mólmassi
Massi eins móls af frumefni er kallaður mólmassi efnisins, en frumefnin eru mismassamikil. Mismunandi samsætur hafa vissulega mismunandi mólmassa en notað er vegið meðaltal þeirra sem finna má í flestum lotukerfum, fyrir neðan nafnið. Þessi tala er notuð fyrir alla mólreikninga, nema tilgreint sé að önnur samsæta sé notuð.
Til að finna mólmassa sameindar er einfaldlega lagt saman mólmassi allra atóma í sameindinni.
Mólmassi, massi og mól tengjast með formúlunni
\[\mathcal{M}\cdot n=m\]
Þar sem \(\mathcal{M}\) er mólmassi í g/mól, \(n\) er mólfjöldi og \(m\) er massinn í grömmum
Dæmi
Hver er massi 100 trilljón sameinda af járn(II)oxíðs, \(\ce{FeO}\)?
Þessi spurning krefst nokkura skrefa. Fyrst þarf að finna hve mörg mól 100 trilljón sameindir eru. Hér er notast við íslensku skilgreininguna á trilljón, þ.e. \(1 \times 10^{18}\) og borið saman við avogadrostöluna.
Til að finna massa sameindanna þarf að finna mólmassa efnanna. Fyrir það er hægt að nota t.d. Ptable. Fyrir járn og súrefni fæst í lotukerfinu:

Í sameindinni er eitt atóm af hvoru svo mólmassi efnisins er þá:
Þá er hægt að finna massa eindanna:
Eins og sjá má nær massi 100 trilljón sameinda ekki einu sinni einu grammi!
2.6.2. Mólstyrkur
Mólstyrkur (e. molar concentration) er mæling á mólfjölda á rúmmálseiningu af lausn. Almennt eru lítrar notaðir sem rúmmálseiningin. Þegar mólstyrkur er reiknaður fyrir jónir þarf að passa að taka mið af fjölda jóna í sameind, t.d. hefur ** \(\ce{CaCl2}\) ** tvær klóríð jónir og þarf því að passa að reikna mólstyrkinn miðað við það (sjá sýnidæmi aðeins neðar).
Mólstyrkur er oft táknaður með \(C\) en einnig er notað tákn eindinnar í hornklofa t.d. táknar \([\ce{Cl^-}]\) mólstyrk klóríðjóna. Eining mólstyrks er mól/L stundum táknuð með M og er kölluð mólar. Þ.e. lausn sem er einn lítri að rúmmáli með einu móli af uppleystu efni er kölluð eins mólar lausn .
Jafnan fyrir mólstyrk er:
Þar sem \(C\) er mólstyrkur, \(n\) er mólfjöldi og \(V\) er rúmmál lausnar í lítrum.
Aðvörun
Rúmmál lausnar getur breyst við það að leysa upp efni og nota ætti það rúmmál í jöfnunni. Ef leyst er upp föst efni s.s. sölt, má oftast nær gera ráð fyrir óbreyttu rúmmáli.
Dæmi
Hver er mólstyrkur magnesíums og klóríðs ef blandað er 2,00 mólum af \(\ce{MgCl2}\) í 1,00 líter af vatni?
Byrjum á að skoða klofnun \(\ce{MgCl2}\)
Hér eru tvær gerðir af eindum og því betra að tákna styrkinn með hornklofum til aðgreiningar. Í hverri sameind af \(\ce{MgCl2}\) er ein magnesíum jón og tvær klóríð jónir.
2.6.3. Mólalstyrkur
Mólalstyrkur (e. molal concentration) svipar til mólarstyrks nema mólalstyrkur er mælieining á mólarfjölda á kíló, í stað lítra. Þetta er almennt óalgengara í efnafræði, en gott að geta gert skil á.
Fyrir vatnslausnir fást sambærilegar tölur enda eðlismassi vatns kringum 1 kg/L.
2.7. Efnaformúlur framhald
Efni getur haft mismunandi efnaformúlur en einna helst er talað um þrjár gerðir af efnaformúlum. Munurinn á þessum formúlum er hve miklar upplýsingar um efnið þær innihalda.
- Reynsluformúla (e. empirical formula)
Þær lýsa einungis hlutfalli frumefna í sameind. Þessi formúla er oft milliskref í efnagreiningu við að finna sameindarformúluna.
- Sameindarformúla (e. molecular formula)
Þær lýsa hlutfalli efna sem og fjölda af hverju og einu atómi.
- Byggingarformúla (e. structural formula)
Þær sýna myndrænt hvernig atómin eru tengd við hvort annað og lýsir þannig byggingu efnisins.
Ef ediksýra er tekin sem dæmi þá er reynsluformúlan hennar \(\ce{CH2O}\) en sameindaformúlan hennar er \(\ce{C2H4O2}\). Byggingarformúla ediksýru er aftur á móti:
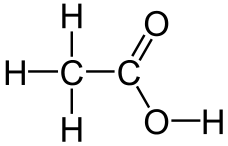
Ef það á að finna hvort að reynsluformúla og sameindaformúla sameindar sé sú hin sama, þarf að komast að mólmassa sameindarinnar. Ef mólmassi reynsluformúlunnar er sá sami, eru formúlurnar þær sömu. Ef ekki, þarf að margfalda reynsluformúlu með heiltölu svo að mólmössunum beri saman.
Dæmi
Glúkósi er einn helsti orkugjafi líkamans, en hann hefur reynsluformúluna \(\ce{CH2O}\) og mólmassa 180,156 g/mól. Hver er sameindaformúla glúkósa?
Hér er fyrsta skrefið að finna mólmassa reynsluformúlunnar. Sambærilega og í dæmi á undan fæst mólmassinn:
Nú þarf að bera saman mólmassa sameindarinnar og reynsluformúlunnar:
Það þarf því greinilega að margfalda reynsluformúluna í gegn með 6 til að fá sameindaformúluna. Sameindaformúlan er þá \(\ce{C_6H_{12}O_6}\).